- Kirjoittaja Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:09.
- Viimeksi muokattu 2025-01-23 12:17.
Jos jaksoittaulukko on mielestäsi hämmentävä ja vaikea ymmärtää, älä huoli, et ole yksin! Jaksotaulukon toiminnan ymmärtäminen voi olla vaikeaa, mutta oppimalla lukemaan sen menestyt tieteessä. Aloita ymmärtämällä jaksollisen taulukon rakenne ja sen näyttämät tiedot elementeistä. Seuraavaksi voit tutkia jokaista elementtiä. Lopuksi käytä jaksollisen taulukon tietoja saadaksesi selville atomien neutronien lukumäärän.
Vaihe
Osa 1/3: Jaksollisen taulukon rakenteen ymmärtäminen
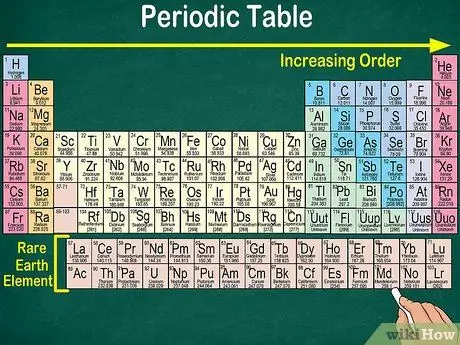
Vaihe 1. Lue jaksotaulukko vasemmasta yläkulmasta oikeaan alakulmaan
Elementit on järjestetty niiden atomiluvun mukaan. Mitä pidemmälle oikealle ja alas, sitä suurempi on atomiluku. Atomiluku on elementin atomin protonien lukumäärä. Kun menet pidemmälle oikealle, huomaat myös, että kunkin atomin massan määrä kasvaa. Eli voit ymmärtää elementin painon edes katsomalla sen sijaintia pöydällä.
- Mitä pidemmälle oikealle tai alas, alkuaineen atomimassa kasvaa, koska atomimassa lasketaan laskemalla yhteen protonit ja neutronit kussakin elementin atomissa. Protonien määrä kasvaa elementin mukana, mikä tarkoittaa, että myös sen paino kasvaa.
- Elektronit eivät sisälly atomimassaan, koska protoneihin ja neutroneihin verrattuna elektronit eivät vaikuta paljon atomipainoon.

Vaihe 2. Ymmärrä, että jokainen elementti sisältää 1 protonin enemmän kuin sen vasemmalla oleva atomi
Voit kertoa tämän katsomalla atominumeroa. Atomiluvut on järjestetty vasemmalta oikealle. Elementit on myös jaettu kolmeen ryhmään, näet ryhmittelyn taulukosta.
Esimerkiksi ensimmäisellä rivillä luetellaan vety, jonka atominumero on 1, ja helium, jonka atominumero on 2. Nämä kaksi elementtiä sijaitsevat kuitenkin taulukon vasemmassa ja oikeassa reunassa, koska ne ovat eri ryhmissä
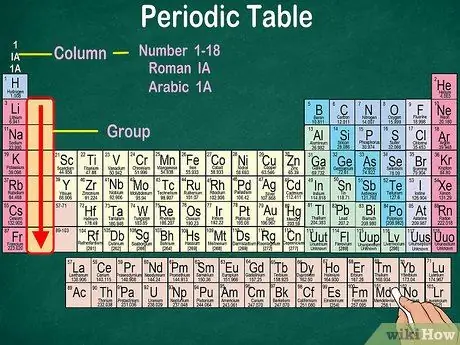
Vaihe 3. Tunnista atomiryhmät, joilla on samat fysikaaliset ja kemialliset ominaisuudet
Ryhmät on merkitty pystysarakkeilla. Useimmissa tapauksissa ryhmille on ominaista sama väri. Tämä auttaa sinua tunnistamaan, millä elementeillä on samanlaiset fysikaaliset ja kemialliset ominaisuudet. Tämä helpottaa näiden elementtien reaktioiden ennustamista. Jokaisella tietyn ryhmän elementillä on sama määrä elektroneja uloimmalla kiertoradallaan.
- Useimmat elementit kuuluvat vain yhteen ryhmään. Vety voidaan kuitenkin luokitella joko halogeeniksi tai alkalimetalliksi. Joissakin taulukoissa vety esiintyy molemmissa ryhmissä.
- Useimmissa tapauksissa sarakkeet numeroidaan 1-18 joko taulukon ylä- tai alareunassa. Numerot voidaan näyttää roomalaisilla numeroilla (IA), arabialaisilla numeroilla (1A) tai numeroilla (1).
- Lue atomiryhmät ylhäältä alas.
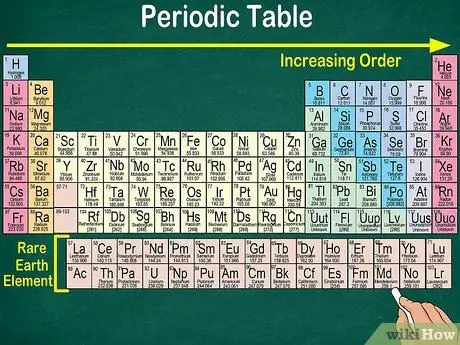
Vaihe 4. Huomaa tyhjä tila taulukossa
Elementtien järjestämisessä ryhmiksi ja ryhmiksi otetaan atominumeron lisäksi huomioon samat fysikaaliset ja kemialliset ominaisuudet. Näin ymmärrät paremmin, miten jokainen elementti reagoi. Kemiallisten elementtien lisääminen vaikeuttaa niiden luokittelua, joten ei ole yllättävää, että jaksollisessa taulukossa on tyhjää tilaa.
- Esimerkiksi kolmessa ensimmäisessä rivissä on tyhjiä välilyöntejä, koska taulukossa näkyvät siirtymämetallit ovat elementtejä, joiden atominumero on 21.
- Vastaavasti elementit 57-71, jotka ovat harvinaisia maametalleja tai harvinaisia maametalleja, on kuvattu erikseen taulukon oikeassa alakulmassa.
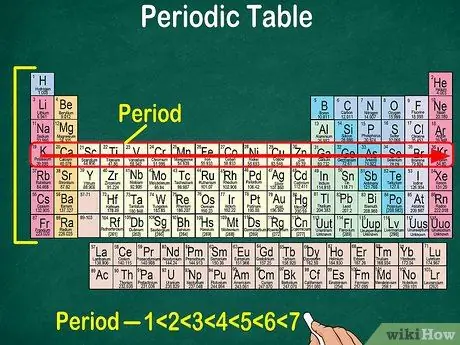
Vaihe 5. Huomaa, että jokaista riviä kutsutaan pisteeksi
Kaikilla ajanjakson elementeillä on sama määrä atomikierteitä, joiden läpi elektronit kulkevat. Kiertoratojen määrä vastaa jaksojen määrää. Jaksotaulukossa on 7 riviä, mikä tarkoittaa, että on 7 pistettä.
- Esimerkiksi jakson 1 elementillä on 1 kiertorata, kun taas jakson 7 elementillä on 7 orbitaalia.
- Useimmissa tapauksissa pisteet on numeroitu 1-7 ylhäältä alas taulukon vasemmalla puolella.
- Lue rivin jälkeisten elementtien kausi vasemmalta oikealle.
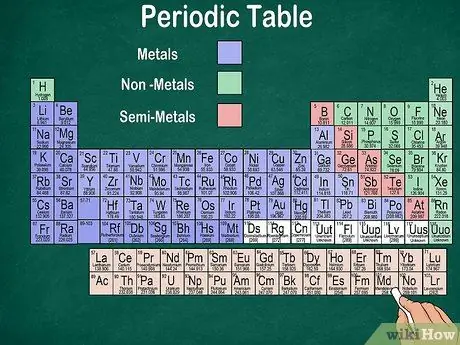
Vaihe 6. Erota metallit, puolimetallit ja epämetallit
Voit ymmärtää paremmin elementtien ominaisuudet tunnistamalla elementin tyypin. Onneksi suurin osa jaksollisesta taulukosta käyttää väriä osoittamaan, onko elementti metalli, puolimetalli vai epämetalli. Pöydän oikealta puolelta löydät metallielementtejä ja vasemmalta ei-metalleja. Puolimetalliryhmä sijaitsee metallien ja ei-metallien välissä.
- Muista, että vety voidaan ryhmitellä halogeenien tai alkalimetallien kanssa sen ominaisuuksien vuoksi. Siksi on luonnollista, että vety ilmestyy pöydän molemmille puolille tai on eri värinen.
- Elementtiä kutsutaan metalliksi, jos se on kiiltävä, kiinteä huoneenlämmössä, johtaa lämpöä ja sähköä ja on pehmeä ja joustava.
- Elementtiä pidetään epämetallina, jos se ei ole kiiltävä, ei johda lämpöä tai sähköä ja on kova. Nämä elementit ovat yleensä kaasumaisia huoneenlämmössä, mutta voivat myös olla kiinteitä tai nestemäisiä tietyissä lämpötiloissa.
- Elementtiä kutsutaan semimetaliksi, jos sillä on metallin ja ei-metallin yhdistetyt ominaisuudet.
Osa 2/3: Elementtien opiskelu
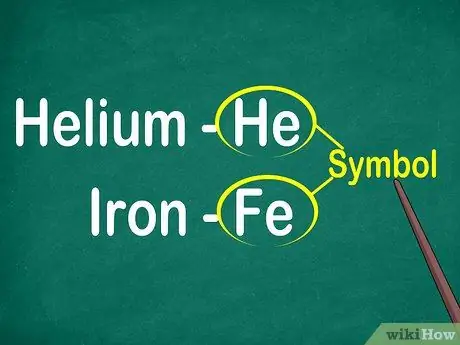
Vaihe 1. Tunnista 1-2 kirjaimen elementtisymbolit
Symboli sijaitsee yleensä neliön keskellä, jossa on suuri kirjasin. Symbolit ovat lyhenteitä elementtien nimistä, jotka on standardoitu eri kielillä. Kun teet kokeita tai työskentelet elementtiyhtälöillä, käytät todennäköisesti elementtisymboleja. Siksi, halusit tai et, sinun on tutustuttava alkuaineiden symboleihin.
Symbolit ovat yleensä johdettu elementin latinalaisesta nimestä, mutta joskus ne ovat peräisin laajalti käytetyistä nimistä, erityisesti uusista elementeistä. Esimerkiksi heliumin symboli on Hän, joka tarkoittaa tätä tunnettua nimeä. Raudan symboli on kuitenkin Fe, joka on suhteellisen vaikea havaita ensi silmäyksellä

Vaihe 2. Etsi elementin täydellinen nimi, jos sellainen on
Tämä on sen elementin nimi, jota käytät, jos sinun on kirjoitettava se kokonaan. Esimerkiksi "Helium" ja "Carbon" ovat elementtien nimet. Useimmissa tapauksissa elementin nimi on symbolin alapuolella, mutta sijoittelu voi vaihdella.
Jotkut jaksolliset taulukot eivät välttämättä sisällä koko nimeä ja käyttävät vain symboleja
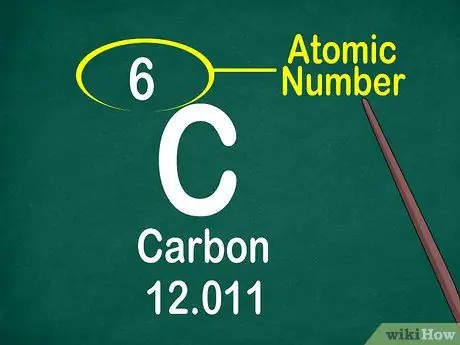
Vaihe 3. Huomaa atominumero
Atominumero sijaitsee yleensä laatikon yläosassa, joko laatikon keskellä tai kulmassa. Atominumero voi kuitenkin sijaita myös elementtisymbolin tai elementin nimen alla. Atomiluvut on järjestetty 1-118.
Atomiluku on kokonaisluku, ei desimaali
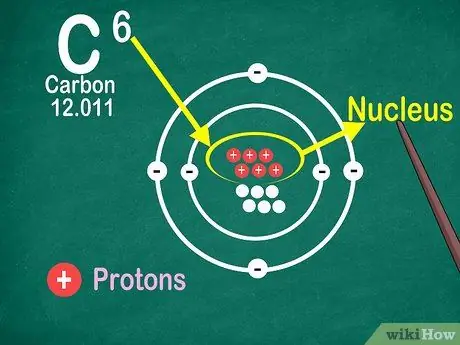
Vaihe 4. Tiedä, että atomiluku on atomin protonien lukumäärä
Kaikissa elementin atomeissa on sama määrä protoneja. Toisin kuin elektronit, atomit eivät voi siepata tai vapauttaa protoneja. Elementit muuttuvat, jos atomit voivat tarttua tai menettää atomeja.
Tarvitset myös atomiluvun elektronien ja neutronien lukumäärän selvittämiseksi
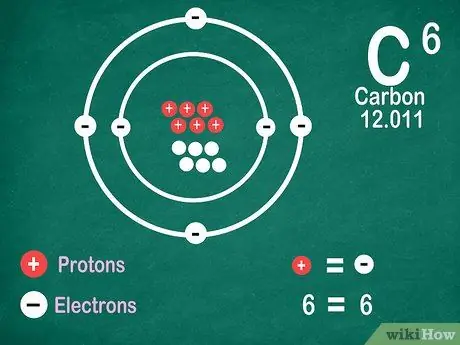
Vaihe 5. Tiedä, että elementit sisältävät saman määrän elektroneja kuin protoneja, ellei alkuaine ionisoidu
Protoneilla on positiivinen varaus, kun taas elektroneilla on negatiivinen varaus. Koska neutraalilla atomilla ei ole sähkövarausta, se tarkoittaa, että sillä on sama määrä elektroneja ja protoneja. Atomit voivat kuitenkin menettää ja saada elektroneja, mikä tekee niistä ionisoituneita.
- Ionit ovat sähkövarauksia. Jos ionissa on enemmän protoneja, varaus on positiivinen, mikä on positiivinen (+) merkki ionisymbolin vieressä. Jos ionien elektronien määrä on suurempi, varaus on negatiivinen, mikä on negatiivinen (-).
- Et näe positiivista tai negatiivista merkkiä, jos atomi ei ole ioni.
Osa 3/3: Atomipainon käyttäminen neutronien laskemiseen

Vaihe 1. Tiedä atomipaino
Atomipaino sijaitsee yleensä laatikon alaosassa elementtisymbolin alapuolella. Atomipaino on atomin ytimen hiukkasten, mukaan lukien protonit ja neutronit, yhteispaino. Ionit voivat kuitenkin vaikeuttaa laskentaprosessia. Siten atomipaino ilmaisee elementin keskimääräisen atomimassan ja sen ionien atomimassan.
- Keskimääräisen painonsa vuoksi useimmilla atomeilla on atomipainot desimaalimuodossa.
- Vaikka elementin paino näyttää siltä, että se kasvaa vasemmalta oikealle, niin ei aina ole.
Vaihe 2. Määritä tutkittavan elementin massanumero
Löydät massan numeron pyöristämällä atomimassan. Tämä tosiasia osoittaa, että atomipaino on kaikkien atomimassojen, mukaan lukien ionit, keskiarvo.
Esimerkiksi hiilen atomipaino on 12 011, joten se pyöristetään 12: ksi. Samoin raudan atomipaino on 55,847, joten se pyöristetään 56: een
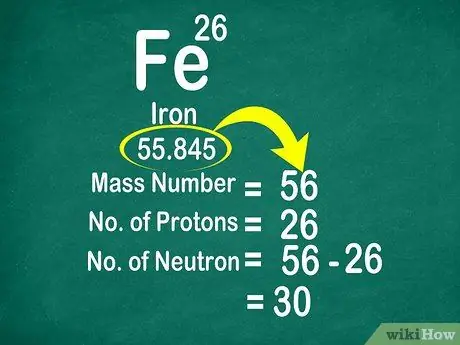
Vaihe 3. Vähennä massan numero atomiluvusta neutronien laskemiseksi
Massaluku voidaan laskea lisäämällä protonien lukumäärä neutronien lukumäärään. Tämä helpottaa atomin neutronien lukumäärän laskemista vähentämällä massan numero protonien lukumäärästä
- Käytä tätä kaavaa: Neutron = Massaluku - Protoni
- Esimerkiksi hiilen massa on 12 ja siinä on 6 protonia. Voimme siis tietää, että hiilellä on 6 neutronia, koska 12 - 6 = 6.
- Toinen esimerkki, raudan massa on 56 ja siinä on 26 protonia. Tiedämme siis, että raudassa on 30 neutronia, koska 56 - 26 = 30.
- Atomien isotoopit sisältävät eri määrän neutroneja, joten niiden atomipainot muuttuvat.
Vinkkejä
- Jaksotaulukon lukeminen on joillekin vaikeaa. Älä lannistu, jos jaksollisen taulukon tutkiminen on sinulle vaikeaa!
- Taulukon värit voivat vaihdella, mutta sisältö pysyy samana.
- Jotkut jaksolliset taulukot voivat antaa puutteellisia tietoja. Esimerkiksi joissakin taulukoissa on vain symboli ja atominumero. Tätä varten etsi tarpeisiisi sopiva pöytä!






